 A
finales del siglo XIX quedó demostrado que los procesos bioquímicos no
requerían necesariamente de la presencia de células vivas, sino que eran
producidos por unas sustancias especiales formadas en las células que
recibieron la denominación de enzimas. Fue Eduard Büchner quien en 1897
comprobó que la fermentación alcohólica de los azúcares se producía usando
solamente un extracto de levadura Saccharomyces libre de células vivas
y, por tanto, dedujo que en este extracto existía la sustancia catalizadora y que
hoy sabemos es una mezcla compleja de enzimas llamadas zimasas. Por este
descubrimiento de gran transcendencia se le concedió el premio Nobel de Química
en 1907.
A
finales del siglo XIX quedó demostrado que los procesos bioquímicos no
requerían necesariamente de la presencia de células vivas, sino que eran
producidos por unas sustancias especiales formadas en las células que
recibieron la denominación de enzimas. Fue Eduard Büchner quien en 1897
comprobó que la fermentación alcohólica de los azúcares se producía usando
solamente un extracto de levadura Saccharomyces libre de células vivas
y, por tanto, dedujo que en este extracto existía la sustancia catalizadora y que
hoy sabemos es una mezcla compleja de enzimas llamadas zimasas. Por este
descubrimiento de gran transcendencia se le concedió el premio Nobel de Química
en 1907.
También
se demostró que, además de la fermentación, otros procesos biológicos como la
combustión y la respiración celular, el metabolismo de las proteínas, lípidos y
carbohidratos, y otras muchas reacciones bioquímicas que se producen en la
célula viva podían ser reproducidas en un tubo de ensayo sin la intervención de
las células. Pero esto sólo era posible si se añadían extractos celulares a la
solución en el tubo de ensayo. Estos principios activos desconocidos, llamados
enzimas o fermentos, se convirtieron en uno de los principales problemas de
investigación durante las primeras décadas del pasado siglo para conocer su
composición y sus efectos. El desafío consistía en poder encontrar métodos para
el aislamiento de las formas puras de estas enzimas y determinar su composición
química. Se suponía que eran sustancias con una estructura química compleja y
con una presencia cuantitativa mínima en las células.
Por
eso resultó muy relevante que James B. Sumner consiguiera en 1926 aislar y cristalizar con éxito una enzima por primera vez, la ureasa. Con este hallazgo, Sumner pudo contradecir a la mayoría de los bioquímicos de
su tiempo que creían imposible cristalizar las enzimas. Pero además pudo
demostrar que las enzimas eran en realidad proteínas cuando se creía que
pertenecían a una categoría aún desconocida de compuestos químicos. El trabajo
innovador de Sumner abrió el camino para seguir investigando la estructura y
efectos de las enzimas puras lo que derivó en sucesivos descubrimientos sobre
el conocimiento de los procesos biológicos que suceden en los organismos vivos.
Hoy
sabemos que la mayoría de las enzimas son proteínas globulares con variable
número de cadenas de aminoácidos que son producidas por las células para
catalizar reacciones químicas a mayor velocidad y cuando no podrían producirse
a la temperatura corporal por lo que son imprescindibles para la vida celular.
Cada organismo tiene sus enzimas propias y cada enzima tiene una diferente
función. Al día de hoy se han identificado más de 3000 enzimas diferentes, pero
se cree que existen muchas más pendientes de identificar.
Biografía de James B. Sumner
James
Batcheller Sumner (1887-1955) nació en Canton (Massachusetts, EEUU), una
localidad muy próxima a Boston, en el seno de una familia acomodada que se
dedicaba a la producción de textiles de algodón. Desde los primeros años en la
escuela sentía predilección por las materias de física y química. A los 17
años, mientras se encontraba de caza, un disparo accidental sobre el antebrazo
izquierdo le provocó una herida que precisó la amputación del antebrazo. Esta
limitación física no le impidió hacer todo tipo de actividades, incluso la
práctica de varios deportes.
 |
James B.
Sumner (1887-1955). Bioquímico norteamericano que consiguió en 1926 aislar
y cristalizar con éxito una enzima por primera vez, la ureasa, demostrando su
naturaleza proteica
En
1906 Sumner ingresó a la Universidad de Harvard (Cambridge, MA, EEUU) consiguiendo
la graduación en Química en 1910. En Harvard coincidió con notables químicos
como Roger Adams, Farrington Daniels, Frank C. Whitmore, James Bryant Conant o
Charles Loring Jackson. Después de breves pasos como docente en la Universidad
de Mount Allison en Sackville (New Brunswick, Canadá) y en el Instituto
Politécnico de Worcester (Worcester, MA, EEUU) decidió ir a la Escuela de
Medicina de Harvard en 1912 para hacer los estudios de doctorado bajo la
dirección del profesor de Bioquímica Otto Folin obteniendo el grado de doctor
en 1914 con la tesis “La formación de urea en el organismo animal”. Este
mismo año es nombrado profesor asistente de Bioquímica en la Escuela de
Medicina de Cornell (Ithaca, NY) ascendiendo a profesor titular en el año 1929.
Sumner fue pionero de la Bioquímica en la Universidad de Cornell y seguiría
desempeñando la función de liderazgo en esta materia hasta su jubilación en
1955.
En
Cornell comenzó su tarea investigadora centrándose primero en los métodos
analíticos pero, a pesar de su tenacidad, no consiguió resultados
satisfactorios. Es entonces cuando decide en 1917 dirigir la investigación para
aislar una enzima en forma pura, algo que nunca se había logrado. Consideró las
posibilidades de este estudio teniendo en cuenta las limitaciones que tenía por
la falta de tiempo para investigar por la carga docente, contar con un
laboratorio dotado de escaso material y aparataje, falta de financiación y
reducido personal asistente.
 |
Planta de la judía variedad jack
(Canavalia ensiformis). Fue la elegida por JB Sumner para realizar sus
investigaciones pues se suponía era muy rica en la enzima ureasa. (A) Vainas. (B)
Semillas
Para
el estudio eligió la planta de la judía variedad jack (Canavalia
ensiformis) que se suponía era muy rica en una enzima, la ureasa, que cataliza
el desdoblamiento de la urea en amoníaco y óxido de carbono. Después de varios
años de investigaciones no había conseguido ningún avance, pero no desistía en su
empeño a pesar que sus colegas le aconsejaban abandonar por considerarlo un
objetivo inalcanzable. En 1921 fue becado para trabajar en la Universidad de Bruselas
con el bioquímico Jean Effront que también consideraba el proyecto de Sumner
como una investigación baldía. De vuelta a Ithaca reanudó sus estudios hasta
que finalmente en 1926 consiguió el aislamiento y cristalización de la ureasa en
forma pura y además pudo demostrar mediante pruebas analíticas que era una
globulina de naturaleza proteica. Esos resultados fueron publicados ese mismo
año en el Journal of Biological Chemestry (J. Biol. Chem., 1926, 69:435-441).
Para
precipitar la ureasa desde el pulverizado de la alubia, Sumner utilizó inicialmente
alcohol al 35% pero en 1926 decidió cambiar a acetona al 31.6% para lograr una
purificación aún mayor. Después de filtrar y centrifugar la disolución en frío
(2.0-2.5ºC) observó al microscopio que se habían formado muchos cristales de
pequeño tamaño. Estos cristales tenían una alta actividad ureasa que era unas
700 veces mayor que el pulverizado de las alubias. También comprobó que era
posible disolver fácilmente los cristales con agua destilada y volver a conseguir
la cristalización varias veces sin que se viera afectada su actividad. Sumner
presentó amplia evidencia experimental de que el material cristalino era la
enzima ureasa, incluida la observación de que las preparaciones más activas de
ureasa que se habían preparado con anterioridad tenían una actividad específica
de 30.000 unidades/g de enzima mientras que los cristales disueltos tenían una
actividad específica de 100.000 unidades/g.
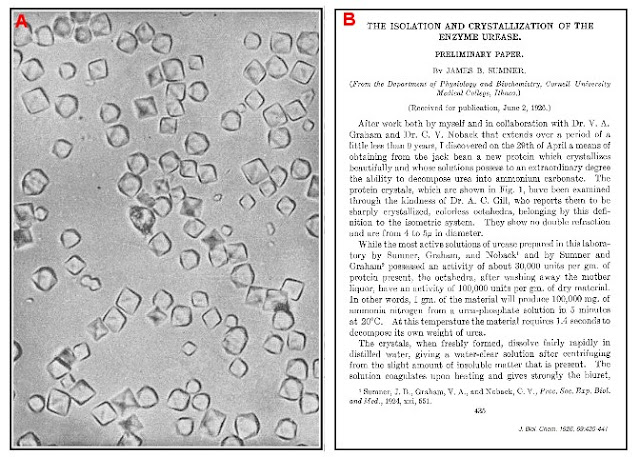 |
(A) Cristales octaédricos de
ureasa (MO x728 diámetros) según imagen original obtenida en la investigación
de JB Sumner. (B) Primera publicación de Sumner anunciando el aislamiento de la
ureasa en 1926 (The isolation and crystallization of the enzyme urease:
Preliminary paper. J. Biol. Chem. 1926; 69:435-41)
La
respuesta que se produjo por parte de la comunidad científica por este
descubrimiento fue de total rechazo e incredulidad. Especialmente dura fue la
oposición de Richard Willstätter, químico alemán de gran autoridad y ganador
del Premio Nobel de Química en 1915 por sus estudios en el campo de los
pigmentos vegetales, que había intentado sin éxito aislar una enzima pura desechando
que éstas pudieran ser proteínas, y consideraba que los cristales formados en
los estudios de Sumner eran del portador de la enzima y no la enzima pura.
Sumner
publicó diez nuevos artículos ofreciendo datos adicionales que reforzaban la evidencia
de que la globulina que había cristalizado era la enzima ureasa. Además, demuestra
que la proteólisis de la ureasa, mediatizada por las enzimas proteolíticas
papaína y pepsina, da como resultado la pérdida de la actividad enzimática
confirmando su naturaleza proteica. Los reconocimientos a su investigación
fueron llegando paulatinamente y el respaldo definitivo se produjo cuando en
1930 John H. Northrop, del Instituto Rockefeller de Nueva York, consiguió la
cristalización de la pepsina y posteriormente de la tripsina y quimiotripsina,
todas ellas enzimas de composición proteica, siguiendo la metodología propuesta
por Sumner por lo que quedó definitivamente establecido que Sumner había
conseguido un método generalizado para la cristalización de las enzimas. Como
reconocimiento a este estudio le fue concedido en 1946 el Premio Nobel de Química
junto a John H. Northrop y Wendell M. Stanley, éste último por conseguir la
cristalización por primera vez de un virus (TMV) demostrando que era un
agregado de moléculas de proteína y ácido nucleico.
Sumner
siguió con su trabajo de investigación sobre enzimas. En 1937 también consiguió
la cristalización de una segunda enzima en forma pura, la catalasa, la enzima que
cataliza la descomposición del peróxido de hidrógeno en oxígeno y agua
ejerciendo un papel protector para las células. En ese mismo año de 1937 consiguió
una beca Guggenhaim desplazándose a la ciudad sueca de Uppsala para trabajar en
el laboratorio del premio Nobel Theodor Svedberg, químico que había
desarrollado la ultracentrifugación analítica. Ese mismo año recibe en
Estocolmo la Medalla de Oro Scheele por sus contribuciones al estudio de las
enzimas. En 1947 es nombrado director del recién creado Laboratorio de Química
Enzimática en la Escuela de Agricultura de la Universidad de Cornell como
reconocimiento a su larga y destacada trayectoria científica.
Su
actividad científica fue muy densa publicando más de 125 artículos en revistas
de prestigio y editó varios manuales que tuvieron gran influencia en el ámbito
docente y de investigación como Textbook of Biological Chemistry en 1927
y, en colaboración con George. F. Somers, Chemistry and Methods of Enzymes
en 1943 y Laboratory Experiments in Biological Chemistry en 1944. En
1951-2 editó junto a Karl Myrbäck una extensa obra de cuatro volúmenes titulada
The Enzymes, Chemistry and Mechanism of Action que contaba con la
colaboración de setenta y ocho científicos. Como reconocimientos honoríficos cabe
también destacar su admisión como miembro electo en la Academia Nacional de
Ciencias de Norteamérica en 1948 y la Asociación Americana de Artes y Ciencias en
1949.
 |
Manual Chemistry and Methods
of Enzymes editado por JB Summer y GF Somers (3 Ed, 1953)
Cuando
estaba implicado en la organización de un programa de investigación sobre
enzimas en la Universidad de Minas Gerais (Belo Horizonte, Brasil) fue
diagnosticado de un cáncer por lo que tuvo que abandonar este proyecto. Entre
los días 25 y 26 de mayo de 1955, la Universidad de Cornell organizó un
simposio en honor de Sumner con motivo de su jubilación. En ese momento ya se
encontraba gravemente enfermo, pero aun así preparó un breve discurso que
cautivó a los asistentes. Al día siguiente fue trasladado al hospital
especializado en cáncer Roswell Park Memorial Institute en Buffalo (NY, EEUU) falleciendo
durante su hospitalización unas semanas más tarde. Sus restos están depositados
en el cementerio Canton Corner de su ciudad natal.
Ureasa. Composición, estructura y efectos biológicos
La
ureasa es una metaloenzima, perteneciente al grupo de las amidohidrolasas, que
cataliza la hidrólisis de urea a amoníaco y dióxido de carbono. El carbamato
producido es posteriormente degradado por hidrólisis espontánea para producir
otra molécula de amoniaco y ácido carbónico y como efecto neto de estas reacciones
se provoca un incremento del pH del medio.
 |
Hidrólisis de la urea por la
enzima ureasa produciendo 2 moléculas de amoniaco y una de ácido carbónico (Konieczna
I et al. Curr Protein Pept Sci. 2012; 13: 789-806)
La
estructura de la ureasa fue desvelada por Jabri et al en 1995 en la
bacteria Klebsiella aerogenes. Las ureasas bacterianas están compuestas normalmente
por tres subunidades distintas, una grande α y dos pequeñas β y γ que forman tres trímeros con una
estructura simétrica de dos pliegos. Las ureasas de las plantas y hongos, por
el contrario, se componen de subunidades idénticas, comúnmente ensambladas como
trímeros y hexámeros. El sitio activo de todas las ureasas conocidas se
localiza en las subunidades α que contiene un centro de dos átomos de níquel
separados con una distancia de unos 3.5 Å. Las moléculas de agua se localizan
hacia la apertura del sitio activo y forman un clúster tetraédrico que llena la
cavidad a través de enlaces de hidrógeno, aquí es donde la urea se une al sitio
activo para la reacción, desplazando a las moléculas de agua. Los residuos de
aminoácidos participan en la unión del sustrato, principalmente mediante
enlaces de hidrógeno, estabilizando el estado de transición y acelerando la
reacción.
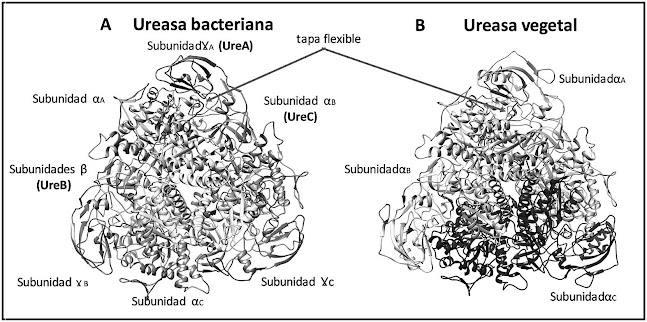 |
Estructura de la ureasa. (A)
Ureasas bacterianas con tres subunidades (modelo Klebsiella aerogenes).
(B) Ureasa de plantas y hongos con una sola subunidad (modelo judía jack)
(Aguirre L et al. Ciencia en la Frontera: Revista de Ciencia y Tecnología de
la UACJ. 2016, Volumen Especial, 19-36)
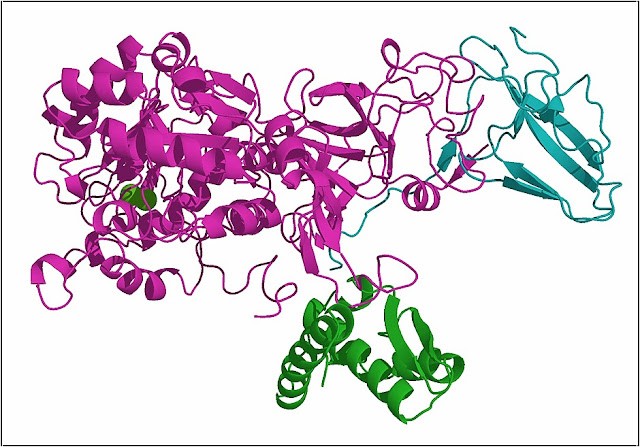 |
Estructura en 3D de la ureasa de la bacteria Klebsiella aerogenes conteniendo dos iones de Niquel (esferas verdes)
Una
estrategia para controlar la actividad de la ureasa para aplicaciones médicas y
agrícolas es usar inhibidores enzimáticos. La ureasa puede ser inhibida por
metales pesados como resultado de la reacción con grupos sulfhidrilo en el
sitio activo de la enzima. Por tanto, los metales que forman los sulfuros más
insolubles son los inhibidores más fuertes de la ureasa. Los compuestos
orgánicos análogos de la urea también pueden inhibir a la ureasa como las ureas
alquiladas, tioureas, hidroxiurea e hidroxámicos.
La
ureasa es producida por una amplia variedad de bacterias, hongos, plantas e
incluso algunos invertebrados. La urea es un producto del catabolismo de las
proteínas en los animales y precisamente fue en 1828 el primer compuesto
orgánico sintetizado debido a Friederich Wöller. La orina humana contiene un 2%
de urea. La ureasa tiene efectos biológicos en los humanos, animales, plantas y
en el suelo. Estos efectos son fundamentalmente beneficiosos debido a que el
reciclaje de la urea suministra a estos organismos el nitrógeno que es tan
necesario para sus funciones vitales y para su crecimiento.
-
Efectos de la ureasa en las plantas
En las plantas, la ureasa se encuentra ampliamente distribuida en semillas y hojas de leguminosas participando en el reciclaje del nitrógeno a partir de la urea y posiblemente también en el transporte del nitrógeno con un papel destacado en la germinación de las semillas. El amoniaco resultante de la reacción puede proteger a la planta contra agentes tóxicos y parece ser que la enzima en sí misma actúa como un insecticida.
En las plantas, la ureasa se encuentra ampliamente distribuida en semillas y hojas de leguminosas participando en el reciclaje del nitrógeno a partir de la urea y posiblemente también en el transporte del nitrógeno con un papel destacado en la germinación de las semillas. El amoniaco resultante de la reacción puede proteger a la planta contra agentes tóxicos y parece ser que la enzima en sí misma actúa como un insecticida.
- Efectos de
la ureasa en el suelo
Muchos
animales excretan urea con la orina. Determinados microorganismos productores
de ureasa existentes en el suelo, como la Sporosarcina pasteurii, hidrolizan
esta urea produciendo amoniaco que es fácilmente accesible a las plantas para
obtener nitrógeno que es crucial para su crecimiento, lo que explica el amplio
uso de la urea en agricultura como fertilizante nitrogenado. Sin embargo, un
exceso de población de microorganismos ureolíticos en el suelo puede ser nocivo
para las plantas por el efecto tóxico del amonio y la marcada alcalinización
del suelo.
- Efectos de la
ureasa en los humanos y animales
Se
han reconocido una serie de efectos beneficiosos de la ureasa bacteriana en los
humanos y animales. Los rumiantes para facilitar la digestión de su dieta
vegetal tienen bacterias ureolíticas en su cámara gástrica para producción de
nitrógeno a partir de la urea producida por estos animales y que excretan en el
rumen. En los humanos la actividad ureolítica de la microbiota intestinal
hidroliza cerca del 15-30% de la urea sintetizada en el organismo ya que el
amonio es la fuente de origen de nitrógeno preferido por las enterobacterias.
Además, bacterias ureolíticas de la boca juegan un importante papel en la salud
dental por su acción contra la formación de caries al contrarrestar la
acidificación del biofilm dental. En el lado negativo, la ureasa puede
actuar como un factor virulento provocando la formación de cálculos urinarios, úlceras
pépticas y otras enfermedades. Estos microorganismos patógenos productores de
ureasa se encuentran en el tracto urinario y gastrointestinal. La ureasa , por
tanto, permite a las bacterias sobrevivir en los ambientes ácidos que
frecuentemente colonizan. Una característica esencial de estas bacterias es su
capacidad de persistir a largo plazo en las células huéspedes. Se puede
detectar la actividad ureolítica mediante la aplicación de test diagnósticos.
 |
| Efectos biológicos en humanos de las bacterias productoras de ureasa (Mora D, Arioli S. PLoS Pathog. 2014; 10(12):1-4) |
Ureasa como factor virulento en humanos
Los
microorganismos productores de ureasa están involucrados en la patogénesis de
una serie de enfermedades como la infección urinaria, litiasis urinaria, gastritis,
úlcera péptica, cáncer gástrico, colitis hemorrágica, artritis reumatoide, espondilitis
anquilosante, aterosclerosis, tuberculosis y neumonías fúngicas.
- Litiasis urinaria
- Litiasis urinaria
La
infección urinaria por gérmenes ureolíticos induce la formación de cálculos de
fosfato amónico magnésico, carbonato apatita y urato amónico, y son la
consecuencia de la formación de amonio y una elevada alcalinización de la orina
por acción de la ureasa bacteriana. En la actualidad este tipo de cálculos
suponen del 5 al 15% de todos los cálculos existentes en humanos. Los
microorganismos ureolíticos más frecuentemente observados son especies de Proteus, Klebsiella, Pseudomonas y
Staphylococcus.
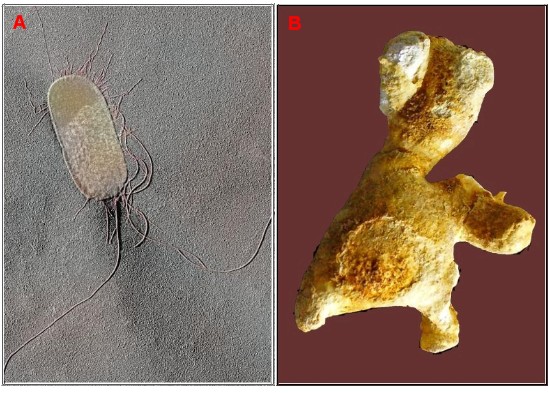 |
| (A) Proteus mirabilis. Bacteria ureolítica más frecuentemente observada en la formación de cálculos urinarios (SEM x29,000). (B) Cálculo renal coraliforme compuesto de fosfato amónico magnésico que se forma en presencia de infecciones urinarias por gérmenes productores de ureasa |
 |
Diagrama de los estadíos en la formación de cálculos por infecciones urinarias por gérmenes ureolíticos (Thomas B, Tolley D.. Nat Clin Pract Urol. 2008; 5(12):668-75)
La
ureasa juega un papel central en la patogénesis de la infección por Helicobacter
pylori ya que el amoniaco generado en la hidrólisis de la urea tiene un
efecto neutralizante de la acidez gástrica proporcionándole protección contra
el bajo pH en el estómago. El H. pylori expresa una gran cantidad de
ureasa que no se observan en otras bacterias y los niveles pueden alcanzar
hasta el 10% de la proteína celular total. La ureasa del H. pylori es
particular ya que combina cuatro de las enzimas regulares de seis subunidades
en un conjunto tetraédrico general de 24 subunidades (α12β12) y se cree que
este ensamblaje supramolecular confiere estabilidad adicional a la enzima en
este microorganismo. La ureasa contiene 12 átomos de níquel por molécula y, por
lo tanto, el H. pylori tiene una demanda relativamente alta de níquel.
- Otras enfermedades
La
ureasa bacteriana puede actuar como un antígeno que estimula al sistema inmune.
Se ha encontrado relación entre los anticuerpos generados por infecciones
crónicas de H. pylori y la patogénesis de la arteriosclerosis. También
se ha establecido una relación entre la artritis reumatoide y la espondilitis
anquilopoyética, enfermedades de base inmunológica, e infecciones por Proteus
mirabilis al haberse observado en estos pacientes altos niveles de
anticuerpos contra la ureasa de la bacteria. También se han detectado
anticuerpos para las ureasas bacterianas de la Yersinia enterocolítica, Haemophilus
influenzae y Brucella.
La
actividad ureolítica también es esencial para la supervivencia del Mycobacterium
tuberculosis, la bacteria causante de la tuberculosis. Esta bacteria
infecta a los macrófagos alterando la maduración de los fagosomas por la
alcalinización provocada por la ureasa y, además, le permite la obtención de
nitrógeno cuando la única fuente es la urea.
Más
recientemente, se ha observado un rol virulento de la ureasa en infecciones
pulmonares por los hongos Cryptococcus neoformans y Coccidioides
posadasii, en donde se genera amonio por hidrólisis de la urea presente en
el líquido del revestimiento epitelial provocando una inhibición de la función
inmune y contribuyendo al daño del tejido pulmonar.
Bibliografía recomendada
-Becker-Ritt AB, Martinelli AHS,
Mitidieri S, Feder V, Wassermann GE, Santi L et al. Antifungal activity
of plant and bacterial ureases. Toxicon. 2007; 50:971–83.
-Jabri E, Carr MB, Hausinger RP,
Karplus PA. The crystal structure of urease from Klebsiella aerogenes.
Science. 1995; 268(5213):998-1004.
-Karplus PA, Pearson MA, Hausinger
RP. 70 years of crystalline urease: Whar have we learned?. Acc. Chem Res. 1997;
30(8):330-7.
-Konieczna I, Zarnowiec P,
Kwinkowski M, Kolesinska B, Fraczyk J, Kaminski Z et al. Bacterial urease and
its role in long-lasting human diseases. Curr. Protein. Pept. Sci. 2012; 13:789-806.
-Maynard LA. James Batcheller
Sumner. In Biographical Memoirs of the National Academy of Sciences. 1958;
31:376-86.
-Mobley HLT, Island MD, Hausinger
RP. Molecular biology of microbial ureases. Microbiol. Rev. 1995; 59(3):451–80.
-Mora D, Arioli S. Microbial
urease in health and disease. PLoS Pathog. 2014; 10(12):1-4.
-Polacco JC, Holland MA. Roles of
urease in plant cells. Int. Rev. Cytol. 1993; 145:65-103.
-Simoni RD, Hill RL, Vaughan M.
Urease, the first crystalline enzyme and the proof that enzymes are proteins:
the work of James B. Sumner J. Biol. Chem; 2002, 277(35):e23.
-Sumner JB. The isolation and
crystallization of the enzyme urease: Preliminary paper. J. Biol. Chem. 1926;
69:435-41.
-Sumner JB. The story of urease.
J. Chem. Educ. 1937; 14:255-9.
-Sumner JB. The chemical nature of
enzymes. Nobel lecture, December 12, 1946. In Nobel Lectures: Chemistry. New
York: Elsevier, 1946.
-Zimmer M. Molecular mechanics evaluation
of the proposed mechanisms for the degradation of urea by urease. J. Biomol.
Struct. Dyn. 2000; 17(5):787-97.
Cómo citar este artículo:
Lancina Martín JA. James Batcheller Sumner (1887-1955) premio Nobel de Química por aislar y cristalizar por primera vez una enzima, la ureasa, demostrando además la naturaleza proteica de las enzimas [Internet]. Doctor Alberto Lancina Martín. Urología e Historia de la Medicina. 2020 [citado el]. Disponible en: http://drlancina.blogspot.com/2020/05/james-batcheller-sumner-1887-1955.html

No hay comentarios:
Publicar un comentario